
我们知道原子(atom)有中心原子核(nucleus)加核外电子(electrons)组成。而核外电子不是杂乱无章的排列在原子核外,而是依照一定的排列规律填充在能级(energy level)上。
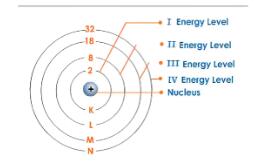
Energy level
Energy level (符号n)根据与原子核nucleus的距离而依次排序。
最低的energy level,n=1,离nucleus最近。
n=2的则稍远。
离原子核越远的energy level,能量越大,同时和nucleus间的吸引力越小。
Q:为什么离原子核越远,反而能量越大,可以用物理中电势能的概念来解释。
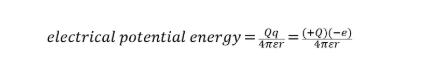
原子核外电子所具有的能量是负的。
因为原子核带正电(+Q),电子带负电(-e),因此电子携带的能量为负。
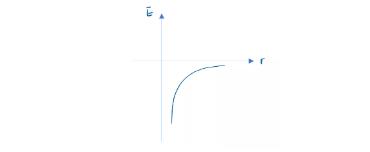
因此电子携带的能量对应于上图,随着距离的增加,能量也在增加。
现代理论中,主能级(main energy levels)会被分成有一些次能级(sub-levels),每一级有轨道(orbitals),轨道上填充着电子(electrons)。前四个能级整理如下:
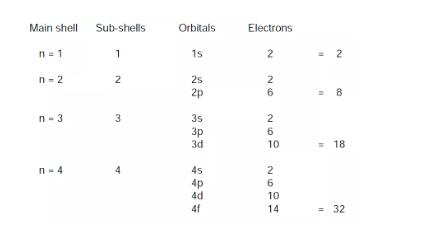
能级对应着主量子数,次能级对应着次量子数,次能级上的次量子数主要由量子数n决定。
如:n=1时次能级的电子云形态为1s,s能级上只能排布最多2个电子;n=2时,次能级的电子云形态为2s和2p,p能级上最多能排6个电子,依次类推。
核外电子排布规律
第一层不超过2个,第二层不超过8个;最外层不超过8个。
每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过2个,第二层不超过8个,第三层不超过18个;
最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)
电子填充顺序
我们可以参考下图来帮助理解电子在原子核外填充的顺序:
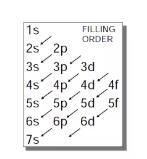
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d…
Q:为什么会先填充4s轨道,而不是3d轨道呢?
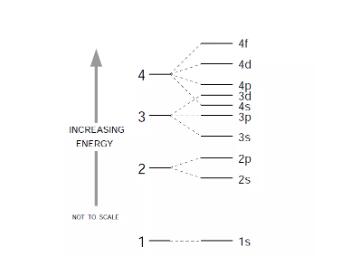
是的,没错,电子是按照能量从低到高排列的,3d轨道比4s轨道能量高,当然得先排4s了。
当然这个图里只排了四层energy level。
更高的energy level中还会出现能量错层的情况,比如说5s,4d,6s,4f等等。
上一篇: alevel课程培训哪家好?要多少钱?

